TROMBOCITOPENIA COMO INDICADOR PREDICTIVO DE CIERRE DEFICITARIO DE DUCTUS ARTERIOSO EN PREMATUROS DEL INSTITUTO NACIONAL MATERNO PERINATAL
DOI: https://doi.org/10.33421/inmp.2019150
Recibido: 01-06-19 || Aprobado: 28-06-19
Autores: Claudia Veralucía Saldaña Díaz1,a, Juan Carlos E. Roque Quezada1 a, Silvio Pedro Saldaña Montesb, Jhony De la Cruz Vargas 1,c.
RESUMEN
Objetivos. Determinar si la trombocitopenia es un indicador predictivo de cierre deficitario de ductus arterioso en prematuros del INMP. Materiales y métodos. Se realizó un estudio de tipo casos y controles. Incluimos 250 recién nacidos prematuros nacidos entre enero a julio del 2016. 87 de ellos presentaron DAP. Empleamos un análisis estadístico descriptivo e inferencial utilizando el paquete estadístico SPSS v.23. Resultados. La trombocitopenia, encontrada en el primer día de vida estuvo asociada de forma estadísticamente significativa con la presencia de DAP (OR=8.9; IC: 95%, 4.7-16.8; p< 0,05). La curva ROC que nos reveló que la trombocitopenia es una prueba de baja sensibilidad (59.2%) y de alta especificidad (89.6%) para diagnosticar DAP. No encontramos asociación entre la respuesta al tratamiento con AINES y la trombocitopenia en estos sujetos. Conclusiones. La trombocitopenia del primer día de vida y el DAP están asociadas de forma estadísticamente significativa, como prueba diagnóstica tiene baja sensibilidad, pero alta especificidad. No encontramos asociación con la respuesta al tratamiento con AINES.
Palabras clave: trombocitopenia, ductus arteriosus, prematuro (Fuente: DeCS BIREME).
INTRODUCCIÓN
El ductus arterioso persistente (DAP) constituye una de las cardiopatías congénitas más frecuentes a nivel mundial, el segundo en frecuencia en Perú1. Existen muchos avances sobre su manejo2, sin embargo su fisiopatología no está del todo concreta. Una investigación reciente2, propuso con un estudio experimental y cohorte retrospectiva complementaria, que el cierre del ductus arterioso requiere de un estado protrombótico el cual sería fundamental tras la constricción inicial del ductus arterioso, para el cierre definitivo de este. Utilizaron modelos murinos, generaron modelos con alteración funcional plaquetaria y con trombocitopenia, encontrando que en ambos casos desarrollaban DAP, demostrando así su teoría2. Extrapolaron sus resultados con una cohorte prospectiva con el objetivo; obteniendo la misma asociación entre trombocitopenia, (recuento plaquetario < 150 000 cel/ml), y la persistencia del DAP2. A partir de estas investigaciones, múltiples estudios, incluidos cohortes prospectivas y metaanálisis3,4 se han realizado para corroborar estos hallazgos, sin llegar a una conclusión definitiva hasta la fecha5-8. El presente artículo tiene como objetivo determinar la relación entre la trombocitopenia y el DAP y aportar información a esta discusión científica.
METODOLOGÍA
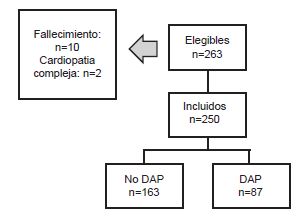
Se realizó un estudio de tipo casos y controles en el Instituto Nacional Materno Perinatal teniendo como población objetivo a los recién nacidos prematuros de entre 22 – 36 6/7 semanas de edad gestacional. La población de estudio consistió en 726 sujetos entre enero – julio del 2016. Se seleccionó una muestra de 265 sujetos de los cuales 250 cumplieron los criterios de selección. De ellos contamos con 87 casos con DAP y 163 controles (Ver figura)
1). Realizamos un análisis estadístico descriptivo e inferencial utilizando el paquete estadístico SPSS v23.
RESULTADOS
De los 265 sujetos seleccionados, solo 250 fueron elegibles. Entre los criterios de exclusión se encuentran los recién nacidos con cardiopatías complejas y aquellos que fallecieron antes de los 3 días de vida.
Figura 1. Diagrama de flujo que muestra el número de pacientes incluidos y excluidos del estudio.
Fuente: INICIB/ INMP 2016
Las características demográficas de los niños con DAP se describen y comparan en la Tabla 1. Se pudo evidenciar que 39.1% de los recién nacidos con DAP tuvieron madres sin controles prenatales, en comparación al 29% del grupo control. El puntaje de APGAR 1’ disminuido se muestra en mayor porcentaje en los sujetos con DAP en comparación con el grupo sin DAP. Esta diferencia se mantiene en el APGAR 5’. Con respecto al sexo no se evidencia una diferencia significativa entre el grupo de casos y control. Así mismo vemos en los recién nacidos con DAP un mayor porcentaje de recién nacidos con menor edad gestacional y con muy bajo peso al nacer.
Fuente: INICIB/ INMP 2016
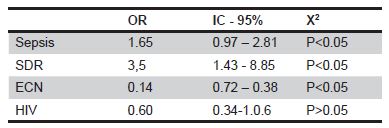
Observamos un mayor porcentaje de sujetos con sepsis y SDR en los sujetos con DAP en comparación a los sujetos sanos. La patología más encontrada fue la enfermedad de membrana hialina (EMH) en ambos grupos.
Con respecto a ECN, este se presenta con más frecuencia en los controles (46.6%), a diferencia del 11.4% de los sujetos con DAP. Finalmente, al estudiar HIV, vemos también un mayor número de casos en los controles en comparación a los recién nacidos con DAP, con un 39.8% versus 28% respectivamente.
Se calcularon los Odds Ratio en relación a las complicaciones neonatales y la presencia de DAP (Tabla 2). Como resultado encontramos 3.5 veces más riesgo de presentar síndrome de distress respiratorio en los sujetos con DAP (OR 3.5, IC 95% 1.43 – 8.85, p< 0.05). Con respecto a sepsis, encontramos una tendencia a estar asociada a DAP (OR: 1.65, IC95% 0.97 – 2.81, p < 0.05). La enterocolitis necrotizante se muestra como un factor protector (OR: 0.14, IC 95% 0.72 – 0.38, p < 0.05) y con la hemorragia intraventricular no se encuentra asociación estadísticamente significativa.
Tabla 2. OR de las complicaciones neonatales en relación a DAP.
Abreviaturas: SDR: síndrome de distress respiratorio, ECN: enterocolitis necrotizante, HIV: hemorragia intraventricular
Fuente: INICIB/ INMP 2016
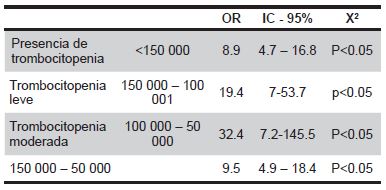
Con respecto a la relación entre la trombocitopenia y el DAP, evidenciamos que los recién nacidos con DAP y presencia de trombocitopenia representa un 53.8%, mientras que 88.3% de los sujetos sin DAP no presentan trombocitopenia. (Tabla 3)
Tabla 3. Tabla cruzada entre el grado de trombocitopenia y la presencia de DAP
Fuente: INICIB/ INMP 2016
Evidenciamos 8.9 veces más riesgo de presentar DAP en presencia de trombocitopenia en el primer día de vida (OR: 8.9, IC 95% 4.7 – 16.8, p<0.005) (ver tabla 4). Esta asociación se mantiene exponencialmente de acuerdo al grado de trombocitopenia evidenciando un OR: 19.4 (IC 95% 7 – 53.7, p<0.005) con trombocitopenia leve, y un OR: 32.4 (IC 95% 7.2 – 145.5, p<0.05) con trombocitopenia moderada. Dado el bajo número de casos con trombocitopenia severa, sus resultados analíticos no son estadísticamente significativos.
Evaluamos la presentación clínica del DAP según el grado de hipertensión pulmonar (HTP), los recién nacidos con DAP presentaron en un mayor porcentaje hipertensión pulmonar moderada en un 41.3%, y solo un 24.1% presentó un grado severo. Considerando que los recién nacidos con hipertensión pulmonar ausente o leve, representan los casos de DAP no hemodinámicamente significativo (DAPNoHS); y a los que tiene hipertensión pulmonar moderada y severa como DAP hemodinámicamente significativo (DAP-HS); cuantificamos 30 y 57 casos respectivamente en cada estadio clínico.
Tabla 4: Grado de asociación entre presencia de trombocitopenia y DAP y grados de trombocitopenia y DAP.
Fuente: INICIB/ INMP 2016
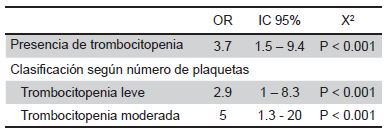
Calculamos los OR en relación a trombocitopenia y DAPHS y lo presentamos en la tabla 4. Encontramos un 3.7 veces más de riesgo de hacer DAP-HS con la presencia de trombocitopenia (Tabla 5).
Tabla 5. Resumen de los OR calculados en relación a la trombocitopenia asociada a DAP-HS
Abreviaturas: Abreviaturas: DAP: ductus arterioso persistente, DAP-HS: ductus arterioso persistente hemodinámicamente significativo. Fuente: INICIB/ INMP 2016
Encontramos 12 casos de reapertura de DAP, no encontramos asociación entre reapertura con trombocitopenia.
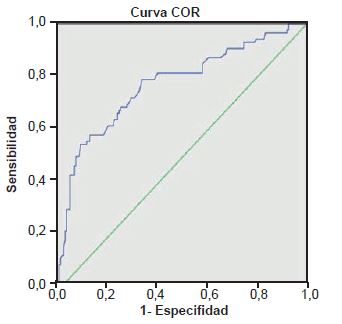
Finalmente, evaluamos la capacidad de la trombocitopenia para predecir la presencia de DAP fabricando una curva ROC. Para considerar una prueba diagnóstica buena, el área bajo la curva debe ser mayor de 0.75. (gráfico 2)
El área bajo la curva nos resultó 0.771 lo cual nos indica que la trombocitopenia es un indicador bueno para predecir DAP.
Para identificar el punto de mayor sensibilidad y especificidad de nuestra curva ROC calculamos el índice de Youden y construimos un gráfico de líneas continuas. Identificamos el punto más alto que fue 148000 plaquetas/ ml el cual representaría nuestro valor de plaquetas con mayor sensibilidad (55.2%) y especificidad 89.6%. (Gráfico 3)
Con respecto al tratamiento inicial que recibieron los pacientes con DAP, encontramos que, de los 87 casos, 59.7 % recibió tratamiento con AINES (Indometacina en todos ellos); solo 2.2% requirió tratamiento quirúrgico como primera opción, y 37.9% recibió tratamiento conservador, no encontramos asociación entre trombocitopenia y respuesta al tratamiento.
Figura 2. Curva ROC (número de plaquetas versus DAP). Área bajo la curva (AUC): 0.771. Considerándose: [0.5, 0.6): Test malo; [0.6, 0.75): Test regular; [0.75, 0.9): Test bueno; [0.9, 0.97): Test muy bueno; [0.97, 1): Test excelente
Figura 3. Gráfico de líneas continuas de índice de Youden para curva ROC.
Punto de corte: 148 000 plaq/ml
Sensibilidad: 55.2%, Especificidad: 89.6%
DISCUSIÓN
Hasta el 2010 el proceso fisiológico del cierre del ductus arterioso era incierto, las teorías existentes no tenían evidencia suficiente para ser concretadas. Echtler y col ese año publicaron un artículo experimental y cohorte retrospectivo en el que demostraron por primera vez el papel fundamental de las plaquetas, tanto en número como en función, en el cierre definitivo del ductus arterioso2.
Múltiples estudios han partido de esa investigación, algunos de ellos confirmando los hallazgos de Echtler como los metaanálisis de Mitra y col3 en el 2016 y el de Simmon y col4 en el 2015, y otros probando lo contrario como el cohorte retrospectivo de Bas-Suarez y col5 del 2014. Dado la controversia generada con estos resultados, el presente estudio se ha realizado con el objetivo de ofrecer argumentos adicionales a esta discusión científica.
Encontramos que la trombocitopenia (plaquetas < 150 000 cel/ml) en el primer día de vida era un factor de riesgo para presentar DAP en los recién nacidos prematuros. Presentando una asociación estadísticamente significativa entre estas dos variables con un OR de 8,9. Estos resultados concuerdan con dos metaanálisis3,4 y con casos y controles como el de Almayac6 en el 2012, quien encontró un OR: 2.68 y cohortes retrospectivas como el de Dani10 en el 2013 quien encontró un OR de 4.5. Esto, a diferencia de estudios como el de Akar y col7 Murphy y col8, Bas Suarez y col5 y Sallmon y col9; quienes encontraron resultados discordantes a los nuestros.
Buscamos además la asociación entre la trombocitopenia y la falla al tratamiento con inhibidores de la Cox para el cierre del ductus arterioso. En nuestro estudio el fármaco usado fue la Indometacina y no encontramos dicha asociación con ningún grado de trombocitopenia al igual que Bas-Suarez y col5 en su cohorte retrospectivo, Alyamac y col6 en su estudio casos y control, Sallmon y col9 en su cohorte retrospectiva y Dani10 en su cohorte prospectiva quien enfocó su estudio en la falla al tratamiento con Ibuprofeno, a diferencia de los otros estudios en los que el inhibidor de la Cox estudiado fue la Indometacina. Sin embargo, existen varios otros estudios que si encontraron relación entre la trombocitopenia y la falla al tratamiento como el metaanálisis de Mitra3 en el 2016 que revisó 1105 estudios y concluyo que existe un 1.75 veces más riesgo de no tener buena respuesta al tratamiento con un bajo número de plaquetas.
Otra relación que encontramos en nuestro estudio fue entre la trombocitopenia y el grado de hipertensión pulmonar generada por el DAP, esto se traduce en la significancia hemodinámica del DAP o también llamado DAP hemodinámicamente significativo (DAP-HS). La mayoría de estudios realizados anteriormente tienen como variable principal el DAP-HS11,12; sin embargo, existen estudios como el de Almayac6 y el de Murphy8 que estudian las dos formas de presentación clínica. En nuestro estudio encontramos que los sujetos con DAP y trombocitopenia tienen 3.7 veces más riesgo de hacer DAP-HS (IC95% 1.5-9.4, p < 0.005), así como lo encontró Almayac6 quien realizó también un estudio caso - control. Esto a diferencia del estudio de Simon4 quien no encontró asociación estadísticamente significativa.
Con respecto a las complicaciones asociadas a DAP, Murphy8 en el 2015 estudio 311 recién nacidos prematuros no encontrando asociación entre DAP y enterocolitis necrotizante y hemorragia intraventricular. Estos mismos resultados encontramos en nuestro estudio, sin embargo, si encontramos asociación con respecto al síndrome de distress respiratorio (OR 3.5 IC95% 1.43- 8.85 p <0.005). Otra complicación que se ha encontrado asociada a DAP en un estudio retrospectivo realizado por Sallmon9 en el 2012 fue la sepsis. En nuestro caso también encontramos asociación.
En teoría hemos aprendido que el cierre fisiológico del ductus arterioso es un mecanismo desencadenado por los cambios hemodinámicos producidos luego de la primera respiración de un recién nacido12,13, sin embargo estos cambios no aparentaban ser suficientes para el cierre definitivo de este ducto14,15 por este motivo se buscaron los mecanismos adicionales responsables de este cierre encontrándose el papel crucial que cumplen las plaquetas en él, esta teoría se demostró en modelos murinos al observar gracias a la microscopia con fluoresceína como las plaquetas se conglomeraban en las paredes endoteliales rotas del ductus arterioso, las cuales habían perdido su continuidad al contraerse de manera brusca tras la primera respiración2,16,17. Las plaquetas cumpliendo su función fisiológica formarían inicialmente una placa plaquetaria y finalmente conglomeraría fibrina formando una cicatriz16-18, siendo esta la responsable del cierre definitivo del ductus. Nuestro estudio probó que ante la presencia de trombocitopenia se presentaba con más frecuencia el ductus arterioso persitente.
En conclusión, podemos mencionar en relación a la asociación de trombocitopenia y DAP concluimos que la trombocitopenia es un factor predisponente de DAP en nuestra poblacion, e implica una prueba diagnóstica de baja sensibilidad, pero con una alta especificidad con un punto de corte de 148 mil plaquetas, teniendo una relación directamente proporcional con el DAP hemodinámicamente significativa. Asimismo, en nuestra población la trombocitopenia es un test adecuado para predecir DAP de acuerdo a los parámetros de la curva ROC. Pero que ésta no sirve como prueba de tamizaje, más si, para fortalecer una sospecha diagnóstica por su alta especificidad. No existe asociación entre la respuesta al tratamiento con inhibidores de la Cox (AINES) y trombocitopenia en nuestra población.
Recomendaciones
Dado los resultados positivos de esta investigación, sugerimos realizar un estudio prospectivo con una mayor población y herramientas estadísticas más potentes para poder corroborar nuestros resultados. Sería importante también realizar un estudio multicéntrico evaluando a diferentes poblaciones y así poder evaluar otros factores intervinientes maternos que puedan influir en el número o la función plaquetaria, y de esta manera detectar poblaciones vulnerables.
Así mismo, recomendamos estudiar otros parámetros plaquetarios que evalúen además la función plaquetaria, tales como la masa plaquetaria, o el RDW-plaquetarios con el objetivo de identificar otros factores que pongan en riesgo a los recién nacidos a desarrollar DAP y sobretodo que se puedan corregir o prevenir incluso intrautero.
Financiamiento: Autofinanciado.
Conflicto de interés: Los autores declaran no tener algún conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Olórtegui A, Adrianzén M. Incidencia estimada de las cardiopatías congénitas en niños menores de 1 año en el Perú. An Fac Med. 2007;68(2):113-24.
2. Echtler K, Stark K, Lorenz M, Kerstan S, Walch A, Jennen L, et al. Platelets contribute to postnatal occlusion of the ductus arteriosus. Nat Med. Enero de 2010;16(1):75-82.
3. Mitra S, Chan A, A Paes B. The association of platelets with failed patent ductus ar- teriosus closure after a primary course of indomethacin or ibuprofen: A systematic review and metaanalysis. J Matern Fetal Neonatal Med [Internet]. 2016
4. Simon SR, van Zogchel L, Bas-Suárez MP, Cavallaro G, Clyman RI, Villamor E. Platelet Counts and Patent Ductus Arteriosus in Preterm Infants: A Systematic Review and Meta- Analysis. Neonatology. 2015;108(2):143-51.
5. Bas-Suárez MP, González-Luis GE, Saavedra P, Villamor E. Platelet counts in the first seven days of life and patent ductus arteriosus in preterm very low-birth-weight infants. Neonatology. 2014;106(3):188-94.
6. Alyamac Dizdar E, Ozdemir R, Sari FN, Yurttutan S, Gokmen T, Erdeve O, et al. Low platelet count is associated with ductus arteriosus patency in preterm newborns. Early Hum Dev. octubre de 2012;88(10):813-6
7. Akar S, Karadag N, Gokmen Yildirim T, Toptan HH, Dincer E, Tuten A, et al. Does platelet mass influence the effectiveness of ibuprofen treatment for patent ductus arteriosus in preterm infants? J Matern-Fetal Neonatal Med Off J Eur Assoc Perinat Med Fed Asia Ocean Perinat Soc Int Soc Perinat Obstet. diciembre de 2016;29(23):3786-9.
8. Murphy DP, Lee HC, Payton KSE, Powers RJ. Platelet count and associated morbidities in VLBW infants with pharmacologically treated patent ductus arteriosus. J Matern-Fetal Neonatal Med Off J Eur Assoc Perinat Med Fed Asia Ocean Perinat Soc Int Soc Perinat Obstet. 2016;29(13):2045-8
9. Sallmon H, Weber SC, Hüning B, Stein A, Horn PA, Metze BC, et al. Thrombocytopenia in the first 24 hours after birth and incidence of patent ductus arteriosus. Pediatrics. septiembre de 2012;130(3):e623-630.
10. Dani C, Poggi C, Fontanelli G. Relationship between platelet count and volume and spontaneous and pharmacological closure of ductus arteriosus in preterm infants. Am J Perinatol. mayo de 2013;30(5):359-64.
11. Chakravorty S, Murray N, Roberts I. Neonatal thrombocytopenia. Early Hum Dev. enero de 2005;81(1):35-41.
12. Bergwerff M, DeRuiter MC, Gittenberger-de Groot AC. Comparative anatomy and ontogeny of the ductus arteriosus, a vascular outsider. Anat Embryol (Berl). diciembre de 1999;200(6):559-71.
13. Dzialowski EM, Sirsat T, van der Sterren S, Villamor E. Prenatal cardiovascular shunts in amniotic vertebrates. Respir Physiol Neurobiol. 31 de agosto de 2011;178(1):66-74
14. Loeliger M, Inder TE, Dalitz PA, Cain S, Camm EJ, Yoder B, et al. Developmental and neuropathological consequences of ductal ligation in the preterm baboon. Pediatr Res. febrero de 2009;65(2):209-14.
15. Zucker-Franklin D. The relationship of alpha granules to the membrane systems of platelets and megakaryocytes. Blood Cells. 1989;15(1):73-9.
16. Rumbaut RE, Thiagarajan P. Platelet-Vessel Wall Interactions in Hemostasis and Thrombosis [Internet]. San Rafael (CA): Morgan & Claypool Life Sciences; 2010 [citado 18 de enero de 2017]. (Integrated Systems Physiology: from Molecule to Function to Disease).
17. Engür D, Kaynak-Türkmen M, Deveci M, Yenisey Ç. Platelets and platelet-derived growth factor in closure of the ductus arteriosus. Turk J Pediatr. junio de 2015;57(3):242-7.
18. Linder N, Shenkman B, Levin E, Sirota L, Vishne TH, Tamarin I, et al. Deposition of whole blood platelets on extracellular matrix under flow conditions in preterm infants. Arch Dis Child Fetal Neonatal Ed. marzo de 2002;86(2):F127-130.
Correspondencia: Claudia Saldaña Díaz. Dirección: Jr. Valle Riestra 160, Pueblo Libre. Correo electrónico: saldimed_1912@gmail.com. Teléfono: 945376469.
1 Universidad Ricardo Palma, Lima- Perú.
a Médico Cirujano, Universidad Ricardo Palma. Lima-Perú.
b Médico Cirujano, Anestesiólogo-Jefe de Servicio DAAR- Instituto Nacional Materno Perinatal, Lima - Perú
c Médico Cirujano, Oncólogo. Director INICIB. Universidad Ricardo Palma. Lima-Perú.
Citar como: Saldaña CV, Roque JCE, Saldaña SP, De La cruz J. Trombocitopenia como indicador predictivo de cierre deficitario de ductus arterioso en prematuros del Instituto nacional Materno Perinatal. Rev Peru Investig Matern Perinat 2019; 8(2):21-6.